Physionomie-écologie
Cet habitat regroupe des formations dominées par des plantes annuelles appartenant surtout aux familles des Chénopodiacées (salicornes, soude) et des Poacées, sur des sols vaseux ou sableux, périodiquement inondés ou aspergés par les eaux marines, de la frange littorale. Quatre grands types de biotopes sont concernés : la slikke et le schorre des vasières tidales, les replats et micro-cuvettes des falaises maritimes, les dépressions dans les dunes et certaines prairies saumâtres arrière-littorales. Selon les faciès, l’habitat occupe des surfaces très ponctuelles de l’ordre du m² (ou moins) comme sur les falaises, alors que dans d’autres comme les prés salés il peut constituer des ceintures assez larges dont la zonation souligne le gradient de submersion par la mer ou divers accidents micro-topographiques (chenaux de drainage, cuvettes). La physionomie varie elle-même fortement en fonction des espèces structurantes – pelouses rases et discontinues à Sagine/salicorniaies hautes et denses – mais le tapis végétal est en général dominé par un faible nombre d’espèces, voire même parfois par une seule (6 des 12 associations connues en Poitou-Charentes sont dominées par une seule espèce de salicorne !). Cependant, la variabilité régionale de l’habitat est forte et, à ce jour, 12 associations végétales ont été décrites.
Les salicorniaies à Salicornia dolichostachya (rare), S.fragilis ou S.obscura et les pelouses à Soude maritime occupent la partie inférieure des prés salés (haute slikke) où elles entrent souvent en contact avec la prairie à spartines.
Les salicorniaies à Salicornia ramosissima, S.pusilla ou S.emerici colonisent le schorre et ses cuvettes mais se rencontrent souvent aussi en arrière des digues, dans des sites halophiles modifiés par l’Homme (marais salants, polders, secteurs conchylicoles). Sur les schorres naturels, elles forment des mosaïques souvent complexes avec les végétations vivaces ou ligneuses des prés salés (voir fiche « Prés salés atlantiques »).
Les pelouses rases à Sagine maritime et diverses Poacées (Parapholis, Desmazeria) ou Brassicacées (Cochlearia, Hymenolobus) se rencontrent dans des biotopes variés mais en général sur des sols à fraction sableuse importante : contact dunes/prés salés, micro-cuvettes des falaises, sentiers littoraux…
Les pelouses à Orge marine ou Orge hérisson sont moins strictement liées à la frange côtière puisqu’on peut les rencontrer sous forme de taches plus ou moins extensives au sein des prairies saumâtres pâturées des grands marais arrière-littoraux sur des sols subissant une dessication intense en été.
Phytosociologie et correspondances typologiques
PVF 2004
THERO-SALICORNIETALIA DOLICHOSTACHYAE Tüxen ex Boullet & Géhu
Salicornion dolichostachyo-fragilis Géhu & Rivas-Martinez
Salicornion europaeo-ramosissimae Géhu & Géhu-Franck
SAGINETALIA MARITIMAE Westhoff, van Leeuwen & Adriani 1962
Saginion maritimae Westhoff, van Leeuwen & Adriani 1962
COR 1991
- 15.1 Gazons pionniers salés
- 15.11 Gazons à Salicorne et Suaeda
- 15.12 Gazons halo-nitrophiles à Frankenia
- 15.13 Groupements à Sagina et Cochlearia
Directive Habitats 1992 et Cahiers d’habitats
- 1310 Végétations pionnières à Salicornia et autres espèces annuelles des zones boueuses et sableuses
- 1310-1 Salicorniaies des bas niveaux (haute slikke atlantique)
- 1310-2 Salicorniaies des hauts niveaux (schorre atlantique)
- 1310-4 Pelouses rases à petites annuelles subhalophiles
Confusions possibles
Les risques de confusion concernent surtout les salicorniaies des prés salés mais le niveau bionomique permet en général de faire la différence entre les salicorniaies de bas niveau et celles du haut schorre. En fin de floraison, la couleur peut être une aide précieuse : les salicornes tétraploïdes des bas niveaux ne rougissent jamais mais deviennent jaunes ou brunes au moment de la fructification alors que les salicornes diploïdes des hauts niveaux virent au rouge plus ou moins intense selon les espèces. L’identification des communautés à Sagine et Poacées requiert quant à elle une attention fine à la structure de la végétation de façon à identifier clairement les effets de mosaïque entre ces pelouses annuelles et les végétations vivaces au sein desquelles elles se développent généralement. Il en va de même pour les « tonsures » à Orge hérisson Hordeum gussoneanum « noyées » au milieu des prairies subhalophiles (15.52).
Dynamique
Comme dans le cas d’autres communautés annuelles, la dynamique de l’habitat est fortement tributaire de l’équilibre plus ou moins stable existant avec les communautés vivaces voisines : selon la prédominance de l’érosion ou de la sédimentation, les végétations annuelles des prés salés peuvent régresser ou disparaître ou, au contraire, prendre de l’ampleur et couvrir de vastes surfaces sur les vasières tidales. Les pelouses à Sagine et Poacées sont quant à elles souvent dépendantes de micro-perturbations (dont le piétinement) qui maintiennent le milieu ouvert. C’est le cas aussi des tonsures à Orge hérisson ou O.marine, entièrement dépendantes d’une pression de pâturage assez forte sans laquelle les Poacées et Cypéracées vivaces envahissent rapidement tout l’espace.
Enfin, la systématique et l’identification de certains groupes comme les Salicornia restent délicates en raison de caractères morphologiques ténus malgré les progrès accomplis au cours des 2 dernières décennies : des controverses existent ainsi encore sur l’identité de certains taxons comme le couple Salicornia emerici/S.nitens par exemple.
Espèces indicatrices
| [plante2] | Cochlearia danica, Desmazeria marina, Hordeum gussonianum, Hordeum marinum, *Hymenolobus procumbens, Parapholis incurva, Parapholis strigosa, Sagina maritima, *Salicornia dolichostachya, Salicornia emerici, Salicornia fragilis, *Salicornia pusilla, Salicornia obscura, Salicornia ramosissima, Suaeda maritima |
| [plante1] | Aster tripolium, Frankenia laevis, Limonium vulgare, Plantago coronopus, Puccinellia maritima, Spartina anglica, Spartina maritima, Spergularia marina |
| [oiseaux] | Branta bernicla, Charadrius hiaticula |
| [orthopteres] | Epacromius tergestinus |
Valeur biologique
L’habitat ne présente pas un intérêt floristique patrimonial très fort puisque 4 espèces rares seulement y sont présentes parmi lesquelles : l’Hutchinsie couchée Hymenolobus procumbens (espèce méridionale) qui n’est connue que d’une poignée de stations fugaces de l’estuaire de la Gironde et des côtes oléronaises ; la Salicorne naine Salicornia pusilla (espèce septentrionale) qui possède son unique localité régionale dans l’estuaire de la Seudre alors que Salicornia dolichostachya sensu stricto (i.e séparé de Salicornia fragilis) serait très disséminée ; l’Orge hérisson Hordeum gussoneanum, enfin, est une espèce méditerranéenne qui trouve sa limite nord dans les prairies arrière-littorales du Centre-Ouest où elle peut toutefois être très abondante. L’intérêt phytocénotique de l’habitat est revanche plus marqué puisque 3 associations végétales figurent au Livre Rouge des Phytocénoses terrestres du Littoral français (GEHU, 1991) : l’HYMENOLOBO PROCUMBENTIS-SAGINETUM MARITIMAE, le PARAPHOLISO-HORDEETUM MARITIMAE et le PUCCINELLIO MARITIMAE-SALICORNIETUM EMERICI. Mal connue (et non encore formellement décrite) la communauté à Parapholis strigosa et Hordeum gussoneanum mériterait aussi de figurer parmi les associations végétales précieuses de l’habitat.
Sur le plan faunistique, certaines salicorniaies constituent le biotope de l’Oedipode des salines, un Orthoptère rare, à l’écologie très spécialisée.
Menaces
Pour les salicorniaies des vasières tidales, la principale menace réside dans d’éventuelles modifications de la dynamique sédimentaire, tant naturelle que d’origine anthropique (digues, enrochements) ; le remblaiement ou l’endiguement de portions de prés salés reste aussi une source potentielle de dégradation. Pour les pelouses rases, un piétinement excessif (tourisme, pêche) peut entraîner une altération de l’habitat alors que la fréquentation des prairies littorales par le bétail semble au contraire indispensable au maintien des tonsures à orges.
3 espèces de salicornes annuelles typiques de différents faciès de l’habitat
 |
 |
 |
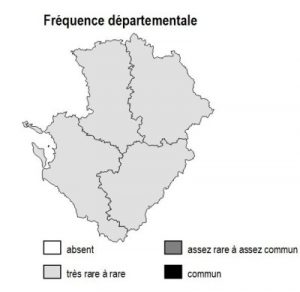
Statut régional
Habitat présent uniquement sur la frange arrière-littorale de Charente-Maritime, sur les côtes insulaires et le long des estuaires de la Charente, de la Seudre et de la Gironde.
Les sites majeurs de prés salés, de contact dunes/prés salés et de falaises maritimes abritant l’habitat ont été intégrés dans les grands inventaires de faune et de flore (ZNIEFF, ZSC, ZPS)
17 : prés salés du Fier d’Ars (île de Ré), prés salés de Boyardville, de Gatseau (île d’Oléron), de la baie de Moëze, falaises de Royan, prairies du marais de Rochefort, du marais de Brouage
 |
 |
 |
 |