Rédacteur : Jean Terrisse
Physionomie-écologie
Les lagunes naturelles correspondent à des plans d’eau côtiers séparés du milieu marin par un cordon de sable ou de galets. Les échanges avec la mer se font soit par l’intermédiaire d’un chenal (le « grau » des lagunes méditerranéennes), soit par percolation sous le cordon soit, dans le cas des lagunes fermées, par incursions lors de tempêtes hivernales ou printanières lorsque les hautes mers de vives eaux peuvent submerger le cordon, poussées par de forts vents d’Ouest et dans un contexte de basses pressions (gonflement barymétrique de l’océan). La profondeur de l’eau est variable mais n’excède généralement pas 1m. La salinité des eaux lagunaires subit de fortes variations saisonnières en fonction du bilan entre les entrées (pluviométrie, apports du bassin versant, incursions marines) et les sorties (évaporation) : minimal en hiver, le taux de chlorures peut dépasser celui de l’eau de mer (sursalure) en fin d’été, lorsque les niveaux sont au plus bas. A cette période, les eaux subissent également un échauffement important qui a des répercussions essentielles sur les organismes vivants présents. Dans tous les cas, la variabilité de ces paramètres – salinité, température – est d’autant moins forte que la lame d’eau est importante et permet un tamponnage des pics. L’assec partiel ou total est possible mais non indispensable au fonctionnement des systèmes lagunaires bien qu’il constitue évidemment une contrainte écologique sévère supplémentaire.
Comme sur l’ensemble de la façade atlantique où la majorité des lagunes ont été aménagées par l’Homme à des fins de production, les lagunes naturelles du littoral charentais ont presque totalement disparu. Le seul type subnaturel subsistant se trouve dans l’Anse des Boucholeurs à mi-chemin entre Rochefort et La Rochelle où il est intégré au périmètre de la Réserve Naturelle du Marais d’Yves : cette lagune, formée de 3 bassins, couvre une superficie de 40 ha ; elle est isolée de l’océan par un cordon sableux peu épais que la mer franchit régulièrement lors des tempêtes hivernales. Les niveaux d’eau maximaux (40-50cm) sont atteints en fin d’hiver (fin mars) lorsque se conjuguent les apports pluviométriques et les entrées dues aux tempêtes, et l’étiage est atteint à partir de la fin juillet où un assec partiel ou total peut se prolonger jusqu’en fin septembre, voire en novembre lors des automnes déficitaires (année 2007). Avec un taux de 5 à 15gr/l selon les bassins, la salinité connaît un creux en hiver (décembre à mars) et remonte à 17-32gr/l lors du pic estival (juillet-août).
Hormis sur ce site privilégié, la totalité des autres lagunes charentaises sont exploitées depuis des décennies, voire des siècles, par l’Homme pour diverses productions – saliculture, ostréiculture, conchyliculture (palourdes, coques), pénéiculture (crevettes), pisciculture – au sein de marais endigués où les entrées d’eau salée sont finement régulées en fonction des besoins propres à chaque production. Selon la nature de l’activité pratiquée, son niveau d’intensivité et la vocation des bassins dans l’exploitation, certains bassins se rapprochent beaucoup par leur fonctionnement et leurs communautés végétales ou animales des lagunes naturelles : c’est le cas, par exemple, dans une exploitation salicole, des bassins situés en amont de la récolte (vasais, métières, tables courantes) par opposition aux champs de marais où s’effectue la récolte et l’essentiel des manipulations. C’est le cas également dans une exploitation ostréicole traditionnelle des claires anciennes, de petite taille (unités de 300-500m²), séparées de nombreuses diguettes (les abotteaux des anciens marais salants, souvent conservés) et de faible profondeur (50-60cm), par opposition aux claires remembrées récentes de grande surface (600-1500m²), avec disparition d’un grand nombre de diguettes et stabilisation par des remblais des digues restantes pour permettre la mécanisation des travaux et le roulage. C’est le cas enfin de certains marais récemment abandonnés, tant que l’hydraulique reste suffisamment fonctionnelle pour permettre un renouvellement de l’eau et éviter le confinement qui favorise les crises de dystrophie. Malgré leur intérêt sur le plan de la biodiversité, ces situations ont cependant un caractère transitoire et ne perdurent pas au-delà de quelques décennies.
La végétation frangeant l’habitat sous forme de linéaires (lagunes aménagées) ou de ceintures (lagunes naturelles) se rapporte à divers habitats de biotopes salés ou saumâtres : salicorniaies annuelles (15.1), prés salés atlantiques (15.3), fourrés des prés salés (15.6), prés salés thermo-atlantiques (15.52), scirpaie maritime (53.7), phragmitaie (53.1). Des herbiers infra-aquatiques dominés par la Ruppie Ruppia maritima sont souvent présents dans les faciès aménagés : ils sont étudiés dans la fiche « Milieux salés artificiels ou fortement anthropisés ».
Les espèces faunistiques sont peu diversifiées mais peuvent être très abondantes (Polychètes, Mollusques bivalves, Crustacés, Hydraires, larves de Diptères). Il s’agit pour la plupart d’espèces se nourrissant de phytoplancton et de débris végétaux (détritivores phytophages). Elles constituent des proies de choix pour divers Vertébrés tels que les Poissons ou les Oiseaux.
Phytosociologie et correspondances typologiques
PVF 2004
RUPPIETEA MARITIMAE J.Tüxen 1960
- Végétation enracinée des eaux saumâtres eury- à polyhalines
- Ruppion maritimae J.Tüxen 1960 : communautés filiformes, hivernales à vernales, souvent desséchées en été
- Zannichellion pedicellatae Schaminée, B.Lanjouw & Schipper 1992 : communautés poldériennes et sublittorales des eaux oligohalines
COR 1991
- 21 Lagunes
- 23.1 Eaux saumâtres ou salées sans végétation
- 23.2 Eaux saumâtres ou salées végétalisées
- 23.21 Formations immergées des eaux saumâtres ou salées
- 23.211 Groupements à Ruppia
- 23.21 Formations immergées des eaux saumâtres ou salées
Directive Habitats 1992 et Cahiers d’habitats
- 1150 Lagunes côtières
- 1150-1 Lagunes en mer à marées (façade atlantique)
Confusions possibles
Par l’originalité de leur localisation physiographique, les lagunes naturelles ne sauraient être confondues avec un autre habitat. Il n’en va pas de même pour les lagunes aménagées : selon les situations, le fonctionnement écologique et les communautés biologiques se rapporteront plutôt à ceux d’une véritable lagune alors que dans d’autres cas, les critères fondamentaux définissant les lagunes – profondeur, température, salinité, communautés de micro-invertébrés – ne seront plus remplis et il sera alors préférable de référer le bassin étudié à l’habitat « Milieux salés artificiels ou fortement anthropisés » (89).
Espèces indicatrices
| [plante2] | *Althenia filiformis, Potamogeton pectinatus, Ranuncuus baudotii, Ruppia cirrhosa, Ruppia maritima, Zanichellia pedicellata |
| [algues] | Chara alopecuroides |
| [oiseaux] | Anas acuta, Anas clypeata, Anas crecca, Anas penelope, Anas platyrhynchos, Branta bernicla, Calidris alba, Calidris alpina, Calidris canutus, Calidris minuta, Charadrius alexandrinus, Charadrius dubius, Charadrius hiaticula, Egretta garzetta, Gallinago gallinago, Haematopus ostralegus, Himantopus himantopus, Limosa lapponica, Limosa limosa, Numenius arquata, Platalea leucorodia, Pluvialis squatarola, Recurvirostra avosetta, Sterna hirundo, Tadorna tadorna, Tringa erythropus, Tringa nebularia, Tringa totanus, Vanellus vanellus |
| [poissons] | Anguilla anguilla, Atherina boyeri, Chelon labrosus, Dicentrarchus spp., Gambusina affinis, Gasterosteus aculeatus, Lepomis gibbosus, Liza aurita, Liza ramada, Mugil cephalus, Platichthys flesus, Pomatoschistus spp., Sparus aurata, Synthagnus abaster |
| [coleopteres] | Chironomus salinarius, Halocladius varians, Sigara selecta |
| [mollusques] | Abra ovata, Cerastoderma glaucum, Hydrobia ventrosa, Potamopyrgus jenkinsi |
| [crustaces] | Artemia salina, Corophium insidiosum, Corophium multisetosum, Gammarus chevreuxi, Gammarus insensibile, Idotea chelipes, Corophium insidiosum, Microdeutopus grillotalpa, Palemonetes varians, Sphaeroma hookeri Hydraires : Cordylophora caspia, Odessia maerotica Polychètes : Ficopotamus enigmaticus, Hediste versicolor, Polydora ligni |
Dynamique
La dynamique des lagunes naturelles est entièrement tributaire de l’action des facteurs qui ont contribué à leur formation et, notamment, du bilan sédimentaire du cordon isolant la lagune de la mer : en cas d’érosion, les entrées d’eau marine se font plus fréquentes et on assiste alors à une « salinisation » du milieu lagunaire qui évolue de plus en plus vers un milieu franchement marin ; en cas d’engraissement du cordon, au contraire, les incursions d’eau salée se raréfient, voire disparaissent totalement, et le milieu évolue alors souvent vers une continentalisation des communautés, avec un atterrissement progressif. Les voies dynamiques des lagunes aménagées sont plus complexes : tant que l’exploitation perdure, les modalités de la gestion hydraulique adaptée au type de production permettent la persistance de conditions lagunaires plus ou moins typiques. En cas d’abandon, en revanche, la défaillance progressive de la desserte hydraulique entraîne inéluctablement un adoucissement des eaux et la dérive des communautés vers des peuplements plus typiques des milieux dulcicoles ; dans ces conditions, un assèchement durable du bassin se produit fréquemment, marquant une sortie souvent définitive du milieu de la zone humide à laquelle il appartenait.
Valeur biologique
L’habitat est considéré comme menacé prioritaire selon l’Annexe I de la Directive 92/43, dite « Directive Habitats ». Sa forte production primaire en fait un support pour de riches populations d’invertébrés, elles-mêmes consommées par différents consommateurs de niveau supérieur : Poissons (Anguille, Bar, Daurade, Flet, Muges spp., Epinoche, Gambusie etc..), Oiseaux. De fait, l’intérêt ornithologique des lagunes – tant naturelles qu’aménagées – est exceptionnel : l’habitat est ainsi un site privilégié tout au long de l’année pour de nombreuses espèces d’oiseaux d’eau – Anatidés, Limicoles, Laridés surtout – qui utilisent les bassins pour accomplir différentes phases essentielles de leur cycle biologique comme la reproduction, l’alimentation ou le repos.
En raison des fortes contraintes écologiques, la flore des lagunes est très peu diversifiée : elle abrite néanmoins plusieurs phanérogames qui leur sont plus ou moins étroitement liées dont, notamment l’Althénie filiforme Althenia filiformis, Potamogétonacée méditerranéenne présente jusqu’aux années 1950 dans les marais salants de l’île de Ré et d’Oléron mais non revue depuis et peut-être disparue.
Menaces
Bien que située au sein d’un espace naturel protégé, l’unique lagune naturelle subsistant en Poitou-Charentes est exposée à diverses menaces naturelles dont la principale semble être l’érosion du trait de côte sous l’effet de divers aménagements périphériques et de l’élévation générale du niveau marin : la fragilisation du cordon séparant la lagune de la mer expose celle-là à des incursions d’eau salée de plus en plus fréquentes et à une modification des paramètres écologiques fondamentaux que sont la salinité ou la température.
Les menaces pesant sur les lagunes aménagées sont d’un tout autre ordre : utilisées depuis des siècles parfois pour des activités traditionnelles comme la saliculture, la pisciculture ou la conchyliculture, elles sont soumises selon les situations à des évolutions contrastées : l’abandon des pratiques d’exploitation et d’entretien qui permettaient une circulation régulière de l’eau entraine une ruine rapide du circuit hydraulique, suivie de crises dystrophiques dans les bassins (disparition de l’oxygène dissous dans l’eau) provoquant une mortalité massive et un appauvrissement rapide des communautés ; un assec de plus en plus prolongé peut également faire disparaitre la totalité des organismes aquatiques ; la menace inverse réside au contraire dans une modernisation des pratiques qui transforme des milieux originellement extensifs en unités d’exploitation intensive où les communautés s’appauvrissent au point de ne plus pouvoir être considérées comme « lagunaires » mais comme relevant d’un autre habitat : les milieux salés artificiels ou fortement anthropisés (89)
 |
 |
 |
Statut régional
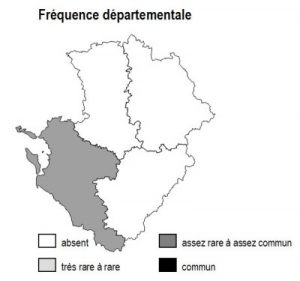
L’habitat n’est présent que sur la façade littorale de Charente-Maritime
17 :
lagunes naturelles : anse des Boucholeurs dans la baie d’Yves (RN du Marais d’Yves) ;
lagunes aménagées : tous les grands sites d’anciens marais salants, abandonnés ou reconvertis pour partie en marais conchylicoles : marais du pourtour du Fier d’Ars (île de Ré), marais de St Pierre, de Grand-Village (Oléron), marais de Seudre
 |
 |