On qualifie d’émergence la phase de développement qui consiste, pour la libellule, à passer du milieu aquatique au milieu terrestre. Cette métamorphose qui transformera la larve en imago implique de multiples modifications physiologiques et morphologiques.
Le déroulement de l’émergence
1) la libellule est hors de l’eau, se positionne et s’apprête à la transformation qui l’attend ;
2) la peau du thorax et de la tête se craquelle, la libellule sort sa tête, son thorax et ses pattes, l’abdomen restant inséré dans l’exuvie ;
3) l’insecte est entièrement sorti mais n’a pas débuté l’extension de son corps et de ses ailes ;
4) les ailes et l’abdomen s’allongent sous la pression des fluides corporels. En fin de cette quatrième phase, l’insecte est capable d’entreprendre son premier vol.
La durée d’émergence varie selon l’espèce et les conditions météorologiques. Chez de nombreux odonates, elle prend entre une et deux heures.
Pour l’insecte, il s’agit notamment de passer d’une respiration aquatique à une respiration aérienne, de maîtriser le vol, d’adopter un comportement sexuel devant favoriser la reproduction de l’espèce.
Au plan morphologique, trois transformations radicales s’opèrent. La plus évidente est le développement des ailes, qui va permettre à l’insecte de se déplacer pour rechercher sa nourriture, des partenaires et éventuellement coloniser de nouveaux sites de reproduction. La face change aussi assez radicalement. Le bras mentonnier des larves disparaît laissant apparaître les puissantes mandibules. Enfin, des larves ternes et camouflées émergent des imagos qui, chez de nombreuses espèces, se teintent de vives couleurs après quelques heures ou quelques jours.
Ces transformations ne sont pas immédiates. Plusieurs jours avant l’émergence, les larves se rapprochent des berges et viennent souvent respirer en surface.
Ses risques
L’émergence est une période critique pour les odonates car durant plusieurs heures leur corps mou ne leur offre aucune protection. Leur survie est une affaire de chance. Que les conditions météorologiques se dégradent, qu’un prédateur repère la libellule et c’en sera fini du combat pour la vie. Chez certaines espèces d’odonates, des milliers d’individus vont se transformer en quelques jours. Leur présence constitue une véritable manne pour de nombreux prédateurs, qui modifient leurs modes de chasse pour focaliser leur attention sur les odonates.
Son déroulement
A leur sortie de l’eau, les larves de libellules gagnent un perchoir où elles pourront se transformer. Selon les espèces et les individus, ce parcours peut n’être que de quelques centimètres, mais certains insectes peuvent se métamorphoser exceptionnellement à plusieurs dizaines de mètres de l’eau.
La plupart des larves se perche sur des supports verticaux pour cette mutation. Certaines entreprennent toutefois leur transformation à l’horizontale (onychogomphes), voire occasionnellement la tête en bas (ischnures).
Le choix du support est essentiel. Il doit permettre à la libellule d’étendre son corps et ses ailes fragiles sans risquer de les abîmer par le contact d’une tige ou d’une branchette balancée par le vent.
Tant que l’émergence n’a pas commencé, les larves peuvent se laisser tomber en cas de danger. Une fois l’enveloppe chitineuse craquelée, le destin des libellules est soumis au hasard.
Record de distance d’émergence
Il est bien connu que certaines espèces d’odonates peuvent se métamorphoser à l’écart de l’eau. Plusieurs auteurs ont décrit des distances d’émergence parfois considérables. Ainsi, Pickess (1987) puis Jôdicke (1994) avancent une distance de 35 m pour l’Orthétrum réticulé Orthetrum cancellatum. Busse et Jôdicke (1996) font état d’émergence à 46 m de l’eau pour Sympétrum de Fonscolombe Sympetrum fonscolombii. Enfin, Coppa (1991) mesure des distances d’émergence pouvant atteindre plus de 50 m pour. La donnée apportée par Siva-Jothy (in Brook & Lewington, 2004 p. 62) concernant une distance d’émergence de 100 m pour Caloptéryx éclatant Calopteryx splendens nous a été confirmée par l’auteur (Siva-Jothy, in litt.). Elle semble constituer le record de distance enregistré en Europe.
La Charente-Maritime semble détenir les records de distance pour deux espèces : la Libellule fauve Libellula fulva avec 21 m et l’Orthétrum à stylets blancs Orthetrum albistylum 19 m (Jourde & Hussey, 2007).
De l’intérêt des exuvies dans l’étude des libellules
La collecte et la détermination des exuvies permettent de dresser l’inventaire des espèces se reproduisant dans l’habitat étudié. Il est parfois plus facile de trouver les exuvies que les imagos de certaines espèces discrètes, notamment de celles qui s’éloignent rapidement de l’eau.
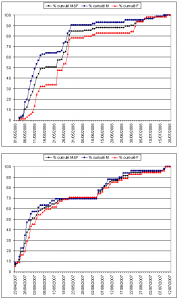
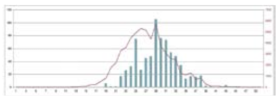
Le dénombrement des exuvies permet aussi de comprendre les modalités d’émergence et de développement des libellules. En collectant quotidiennement toutes les exuvies d’une espèce dans un endroit donné, il est possible de déterminer sa phénologie d’émergence, de calculer la date à laquelle 50 % des émergences ont eu lieu (EM50) ou la période durant laquelle 90 % des émergences se sont produites (EM90).
Le décompte des exuvies peut aussi permettre de suivre l’évolution des populations dans le long terme et d’identifier les milieux optimaux de développement larvaire de chaque espèce.
Période d’émergence
On différencie généralement les espèces dites printanières, dont les émergences sont relativement synchrones, des espèces dites estivales, dont les émergences sont très étalées dans le temps. En fait, en fonction de leur environnement, une espèce peut être printanière ou estivale, voire les deux. Le Gomphe vulgaire Gomphus vulgatissimus fait partie des espèces printanières. L’Anax empereur Anax imperator peut être les deux. L’Aesche affine Aeshna affinis est une espèce de type estival.
Comme pour la date d’éclosion, la date d’émergence est aussi fonction des conditions environnementales. Pour une espèce donnée, elle varie d’un site à l’autre et d’une année sur l’autre.
Bibliographie
Brooks S., Lewington R., 2004 – Field guide to the dragonflies and Damselflies of Great Britain and Ireland. 4ème édition. British Wildlife Publishing, Hook, 142 p.
Busse R., Jödicke R., 1996 – Langstrecken-marsch bei der Emergenz von Sympetrum fonscolombei (Sélys) in der marokkanischen Sahara (Anisoptera : Libellulidea). Libellula, 15 : 89-92.
Coppa G., 1991 – Notes sur l’émergence d’ (Charpentier) (Odonata : Cordudliidae). Martinia, 7 (1) : 7-16.
Jödicke R., 1994 – Marcha de larga distancia para la emergencia en Sympetrum fonscolombei (Sélys) y Orthetrum cancellatum (L.). Navasia, 3 : 5-6.
Jourde P., Hussey R., 2007 – Quelques cas d’émergences distantes de l’eau chez Ladona fulva (Müller, 1764) et Orthetrum albistylum (Selys, 1848) (Odonata, Anisoptera, Libellulidae). Martinia, 23 (2) : 67-69.
Pickess B.P., 1987 – How far will larvae of Orthetrum cancellatum (L.) travel for their emergence ? JBDS, 3 : 15-16.