Rédacteur : Jean Terrisse
Physionomie – écologie
En Poitou-Charentes, l’habitat occupe un certain nombre de biotopes humides temporaires caractéristiques de la frange arrière-littorale (jamais à plus de 5km de la mer) des côtes basses à sédimentation estuarienne : pourtour des mares abreuvoirs au sein des complexes de prairies saumâtres, pas inter-parcellaires piétinés et défoncés par le bétail, « jas » (anciennes salines isolées de l’eau marine par la poldérisation), dépressions, mares cynégétiques (gérées avec un assec estival), fossés à niveau d’eau variable, chemins du marais (non empierrés ni stabilisés par des matériaux exogènes) etc. Dans tous les cas, le substrat est argileux, à structure fondue, souvent compacté par le bétail, bien pourvu en calcaire et présente une chlorosité résiduelle (anciennes alluvions fluvio-marines déposées lors de la transgression flandrienne). Le milieu est inondé du milieu de l’automne à la fin du printemps, soit environ 7-8 mois, sous une fine couche d’eau d’origine météorique ou provenant du réseau syndical de fossés drainant le marais. L’exondation intervient courant juin et l’habitat connaît son optimal phénologique en juillet-août. L’habitat est structuré par une végétation rase, paucispécifique (6.3 espèces en moyenne sur 18 relevés effectués en 17) et peu recouvrante (recouvrement de 20 à 80% mais le plus souvent situé entre 20 et 40%. Les thérophytes représentent en général plus de la moitié du cortège et nombre d’entre eux possèdent des adaptations aux conditions stationnelles drastiques (succession de phases inondée/sèche, piétinement, sol salé peu évolué) : appareil végétatif prostré (Crypsis) ou très plastique morphologiquement (Atriplex). Le pâturage est un autre facteur essentiel car il bloque le développement des vivaces et permet le maintien de zones de sol nu où l’habitat se développe. Les Crypsis y sont remarquablement adaptés puisque leurs tiges rampant sur le sol se cassent très aisément et les « têtes florales » sont emportées entières par le bétail qui disperse ainsi l’espèce dans d’autres sites favorables. Sur le littoral de la Charente-maritime, la variabilité de l’habitat s’organise selon un gradient de salinité : le faciès méso-halin est caractérisé par divers halophytes tels que le Jonc de Gérard Juncus gerardii ou la Salicorne rameuse Salicornia ramosissima, alors que le pôle oligo-halin voit le Scirpe des marais Eleocharis palustris et l’Agrostide stolonifère Agrostis stolonifera prendre de l’importance. Les autres faciès de l’habitat, de nature physionomique, dépendent surtout des végétations en mosaïque avec le gazon à Crypsis : scirpaie maritime, scirpaie lacustre…
Phytosociologie et correspondances typologiques
PVF 2004
Alliance Heleochloion schoenoidis Br.-Bl. 1956
Communautés eutrophiques halonitrophiles d’affinités subméditerranéennes
COR 1991
22.34 Gazons amphibies méridionaux
22.343 Gazons méditerranéens amphibies halo-nitrophiles
Directive Habitats 1992 et Cahiers d’habitats
3170 Mares temporaires méditerranéennes
3170-3 Gazons méditerranéens amphibies halo-nitrophiles
Confusions possibles
Par son écologie et les biotopes très spécifiques qu’il occupe, l’habitat ne peut guère être confondu. Contrairement à la région méditerranéenne où l’habitat se décline en plusieurs habitats élémentaires, ses occurrences centre-atlantiques sont beaucoup moins variées. Néanmoins les situations mixtes sont nombreuses où le gazon à Crypsis forme une mosaïque ouverte avec la scirpaie maritime. De même, en cas de dérive nitrophile, des situations intermédiaires, avec des cortèges hybrides, peuvent se présenter entre le gazon eutrophe à Crypsis et la communauté nitrophile à Chénopode à feuilles grasses qui occupe des biotopes similaires mais dans des conditions de trophie distinctes.
Dynamique
Sous climat thermo-atlantique, le gazon à Crypsis connaît un équilibre dynamique fragile. L’intensité de la pluviométrie et la durée d’ensoleillement règlent la durée et les dates de la période d’exondation au cours de laquelle l’habitat se développe. En régle générale, le gazon à Crypsis succède dans le temps à des communautés aquatiques à callitriches (C.brutia, C.truncata, surtout) et renoncules du sous-genre Batrachium (R.baudotii, R.gr.trichophyllus) qu’il remplace après exondation du substrat. En cas d’assec trop tardif ou absent, le gazon ne s’exprime pas et risque d’être supplanté lors des années suivantes par les hélophytes. De même, la régression ou la disparition du pâturage, favorisent le développement des espèces vivaces très concurrentielles. Certains phénomènes climatiques exceptionnels, comme l’ouragan « Martin » de décembre 1999 qui a provoqué une submersion prolongée de la bande littorale par les eaux marines, semblent très favorables à l’habitat par l’apport massif de sel dans le substrat qui semble stimuler la germination du Crypsis.
Espèces indicatrices
| [plante2] | Atriplex prostrata, *Chenopodium chenopodioides, *Crypsis aculeata, *Crypsis schoenoides |
| [plante1] | Agrostis stolonifera, Alopecurus bulbosus, *Centaurium spicatum, Centaurium tenuiflorum, Coronopus squamatus, Eleocharis palustris, Hordeum marinum, Juncus gerardii, Polygonum aviculare, Polypogon monspeliensis, Salicornia ramosissima, Scirpus maritimus, Spergularia salina |
Valeur biologique
L’habitat constitue le milieu exclusif pour 2 Poacées du genre Crypsis, toutes les 2 inscrites au Livre Rouge de la Flore Menacée de France : le Crypsis piquant Crypsis aculeata, connu aujourd’hui encore de 4 des 5 grands marais arrière-littoraux de Charente-maritime (curieusement, la plante n’est pas connue des marais de Seudre où, pourtant, les biotopes favorables ne manquent pas), parfois en populations importantes (plusieurs milliers de pieds), notamment dans certains espaces protégés bénéficiant d’une gestion favorable (RN du Marais d’Yves, RN des marais de Moëze). Le Crypsis faux-choin Crypsis schoenoides, à l’inverse, connu jusque durant les années 1970 du marais de Rochefort et des marais de l’estuaire Gironde n’a pas été revu depuis près de 30 ans et est considéré comme disparu. Le reste du cortège végétal, qui emprunte ses éléments aux végétations en contact spatial – prairies subhalophiles thermo-atlantiques – ou liées dynamiquement – roselière oligo-haline à Scirpus maritimus, parvo-roselière à Eleocharis palustris – n’abrite en revanche que des espèces communes.
Menaces
Sur la façade atlantique, cet habitat très ponctuel est lié à des conditions hydriques et des modalités agro-pastorales bien précises dont l’altération signifie souvent sa disparition pure et simple. L’abandon du pâturage des prairies arrière-littorales induit une fermeture du tapis végétal et une disparition des zones de sol nu, notamment au niveau des anciennes mares-abreuvoirs qui constituent le biotope électif de l’habitat. En cas d’hygrophilisation (niveaux d’eau plus élevés et/ou plus prolongés), l’habitat est progressivement envahi par des hélophytes coloniaux – Scirpe maritime et Scirpe des marais, surtout – qui vont à terme détruire les gazons à Crypsis par réduction de l’éclairement et accumulation de litière organique sur le sol où les Crypsis ne peuvent plus germer. Le gazon eutrophe à Crypsis aculeata est alors remplacé par une communauté plus franchement nitrophile où l’Arroche prostrée est associée au Chénopode à feuilles grasses Chenopodium chenopodioides, très compétitif et très recouvrant. Par sa situation propé-littorale, l’habitat est par ailleurs exposé aux menaces propres à cette tranche convoitée de territoire : spéculations foncières, changements d’affectation, urbanisation…
Statut régional
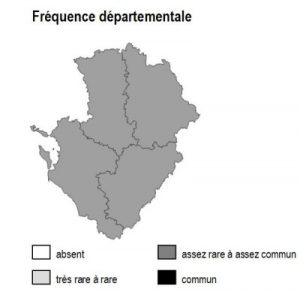
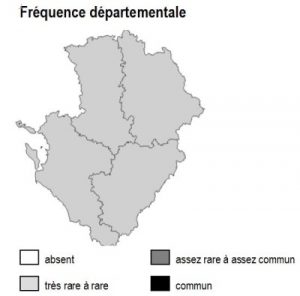
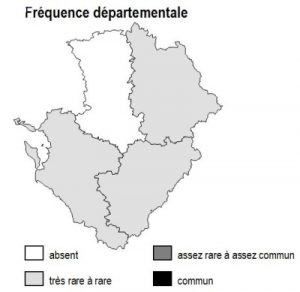
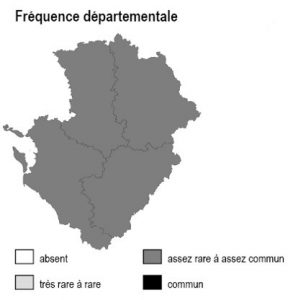
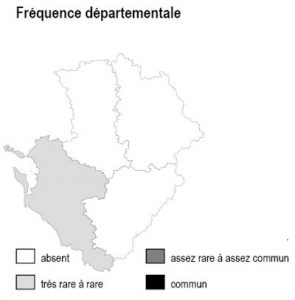
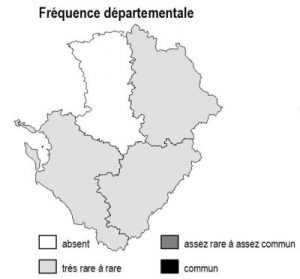
Habitat présent uniquement sur la frange arrière-littorale de 17 et le long de l’estuaire de la Gironde, où il reste partout ponctuel et extrêmement localisé.
Tous les sites abritant l’habitat sont intégrés et décrits dans les inventaires du patrimoine naturel récents (ZNIEFF, NATURA 2000) auxquels on se reportera pour plus de détails.
17 : Réserve Naturelle du Marais d’Yves, Réserve Naturelle des Marais de Moëze, marais de Rochefort, prairies de l’estuaire Charente.

Deux situations typiques de l’habitat