Rédacteur : David Ollivier
Physionomie – écologie
Les parois rocheuses siliceuses du Poitou-Charentes sont principalement composées de roche granitique et plus localement de formations géologiques schisteuses. Ces falaises verticales ne permettent l’installation de la végétation qu’à l’occasion des fissures de la roche et les végétaux y sont plutôt dispersés, localisés et discrets. Le sol issu de la dégradation de la roche est pauvre en bases et en nitrates. L’enrichissement en matières azotées contribue à la variabilité de l’habitat en favorisant la présence de plantes nitrophiles au détriment du cortège spécifique caractéristique. Les plantes vasculaires sont représentées surtout par les fougères accompagnées d’une certaine abondance de lichens et de bryophytes. Selon l’exposition et les conditions d’humidité, les périodes de sécheresse peuvent être prolongées et les amplitudes thermiques parfois importantes (conditions héliophile et thermophile), ce qui favorisent la présence d’une flore particulièrement spécialisée tels que les sedums ou le Nombril de Vénus. En revanche, certaines espèces supportant mal la dessiccation, telles que la Doradille de Billot Asplenium obovatum subp. billotii vont préférer les roches très ombragées et dont les fissures collectent les eaux de pluie.
En Poitou-Charentes, l’habitat est entièrement regroupé dans les falaises eu-atlantiques siliceuses (Asplenio billotti-Umbilicion rupestris) et se décline en 2 associations végétales et plusieurs groupements à statut incertain :
- en conditions thermophiles et héliophiles, communauté à Umbilicus rupestris et Silene vulgaris ssp. bastardii ( Umbilico rupestris-Silenetum bastardii )
- en conditions hygrophiles-sciaphiles, communauté à Asplenium obovatum ssp. billotii et Umbilicus rupestris (Umbilico rupestris-Asplenietum billotii).
Au titre des groupements de statut incertain, il faut mentionner une communauté à Polypodium cambricum (existe aussi sur rochers calcaires mais avec une composition floristique différente), une communauté appauvrie ne possédant que quelques Asplenium et/ou Polypodium vulgare.
Phytosociologie et correspondances typologiques
PVF2004
ASPLENIETALIA SEPTENTRIONALIS Oberdorfer al. ex Loisel
Asplenio billotii-Umbilicion rupestris de Foucault
Umbilico rupestris-Silenetum vulgaris ssp. bastardii (Godeau) de Foucault, Godeau Bouzillé in de Foucault
Umbilico rupestris-Asplenietum billotii de Foucault
CORINE 1991
62.21 Falaises siliceuses des montagnes médio-européennes
62.212 Falaises siliceuses hercyniennes
Directive Habitats 1992 et Cahiers d’habitats
8220-13 Végétation chasmophytique des pentes rocheuses silicicoles
Confusions possibles
Il n’existe pas de confusion possible avec un autre habitat naturel. Les falaises siliceuses, outre la nature de la roche, présentent une végétation relativement différente des parois calcaires, composée en autres d’Asplenium septentrionale, Umbilicus rupestris ou encore d’Asplenium obovatum subsp. billotii. Certaines fougères, apparemment indifférentes à la nature de la roche, telles que Asplenium trichomanes, ont en fait différencié des sous-espèces distinctes selon le substrat : ssp.quadrivalens sur calcaire et ssp.trichomanes sur silice.
L’abondance des lichens caractérise assez souvent les parois siliceuses, contrairement aux parois calcaires où ils sont généralement moins fréquents.
Dynamique
La végétation des parois siliceuses peut se développer grâce à l’accumulation d’humus et de particules minérales au sein des fissures de la roche. Le sol est donc de très faible profondeur parfois même quasi inexistant et ne permet généralement pas l’installation d’espèces ligneuses hormis peut être quelques Ericacées dans les anfractuosités les plus prononcées.
La dynamique naturelle de ce type d’habitat est donc quasiment stable.
Il arrive parfois que le lierre « escalade » la falaise pour former une nappe dense et uniforme au détriment de la végétation chasmophytique des parois.
Espèces indicatrices
| [plante2] | *Asplenium foreziense, *Asplenium obovatum subp. billotii, *Asplenium septentrionale, Asplenium trichomanes ssp trichomanes, Micropyrum tenellum, Sedum album, sedum rupestre, Umbilicus rupestris |
| [plante1] | Coincya cheiranthos, Digitalis purpurea |
| [briophytes] | Amphidium mougeotii Barbilophozia attenuata, Barbilophozia barbata, Bartramia pomifera, Campylopus pilifer, Campylopus polytrichoides Cynodontium bruntonii, Dicranoweisia cirrata, Diplophyllum albicans, Grimmia decipiens, Grimmia laevigata, Grimmia montana, Hedwigia ciliata, Jamesionella autumnalis, Marsupella emarginata, Metzgeria conjugata, Plagiothecium nemorale, Plagiothecium succuletum, Pterogonium gracile, Racomitrium heterostichum, Racomitrium lanuginosum, Scapania compacta, Schistostega pennata, Targionia hypophylla, Tritomaria quinquedentata |
| [lichens] | Buellia sp., Chrysothrix candellaris, Cladonia coccifera gr, Diploschistes scruposus, Lecanora orosthea, Lepraria sp., Parmelia conspersa, Parmelia omphalodes, Parmelia pulla, Pertusaria lactea, Rhizocarpon gr.geographicum, Tephromela atra, Umbilicaria pustulata |
| [champignons] | Geopora arenosa |
Valeur biologique
Les parois rocheuses siliceuses abritent une flore originale et très spécialisée participant à la biodiversité ordinaire mais aussi patrimoniale du Poitou-Charentes. Certaines espèces sont en effet rares à très rares pour la région, telles que la Doradille de Billot Asplenium obovatum subsp. billotii disséminé en quelques localités au sein du Poitou-Charentes et la Doradille du Forez Asplenium foreziense connue seulement d’une unique station contenant une seule touffe.
Les parois rocheuses servent par ailleurs de support de nidification à certains oiseaux rares dans la région et protégés tels que le Faucon pèlerin ou simplement d’habitat de chasse et d’hivernage à d’autres espèces non nicheuses.
Menaces
La végétation des parois rocheuses se développe sur un sol quasi inexistant et de ce fait est très sensible à l’érosion et au piétinement. Quelques exemples en région Poitou-Charentes montrent que la pratique intensive de « sports de nature » tels que l’escalade sur ce type de parois nuit au maintien de cet habitat naturel sensible en bon état de conservation d’autant que la pratique de ce sport est parfois accompagnée de traitements herbicides de la roche.
Les plantes à croissance relativement difficile et lente mettront beaucoup de temps à recoloniser ce type de milieu après de telles perturbations d’origine anthropique.
La proximité des activités humaines telles que la présence d’une zone urbaine dans l’environnement proche des falaises constituent parfois une menace de banalisation des espèces de cet habitat soit par apparition d’espèces exogènes envahissantes échappées des jardins voisins, soit par une gestion plutôt « jardinée » pratiquée parfois par les services d’entretien municipaux. Ce type de gestion se traduit souvent par l’introduction d’espèces horticoles et par l’usage d’herbicides.
Statut régional
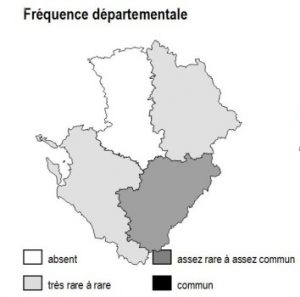
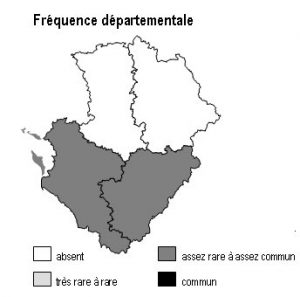
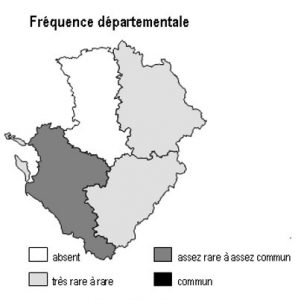
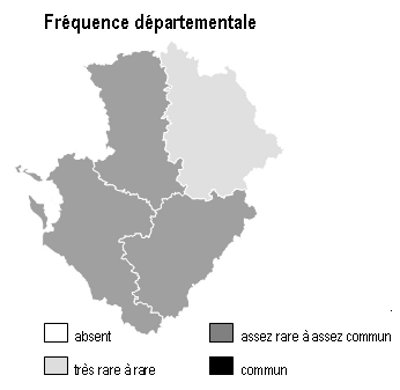
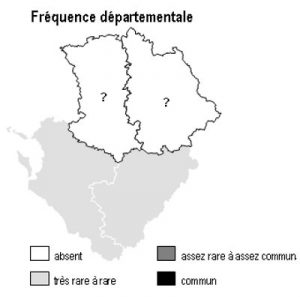
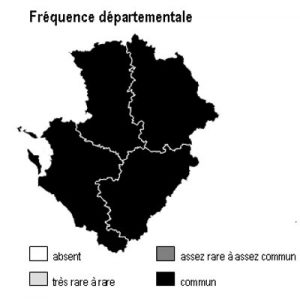
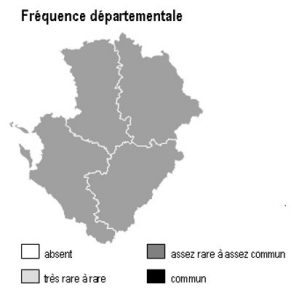
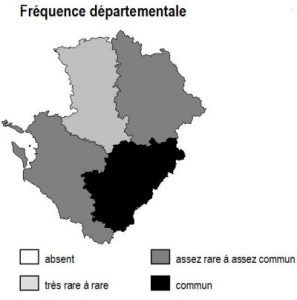
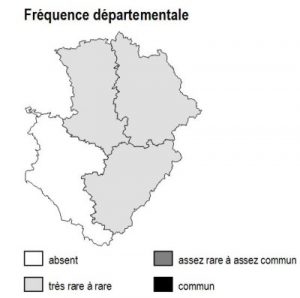
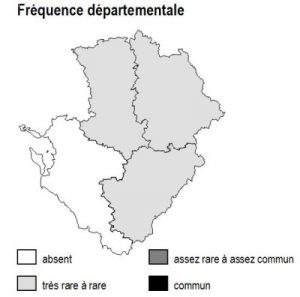
Dans la région Poitou-Charentes, ce type de milieu est localisé aux affleurements cristallins présents aux confins du Limousin des départements de la Charente et de la Vienne, mais aussi à la faveur de discordances géologiques (Ligugé, 86) ou encore au sein de la Gâtine Poitevine dans le département des Deux-Sèvres. Il manque totalement en Charente-Maritime.
Sites remarquables :
16 : gorges de l’Issoire (St Germain-de-Confolens), vallée de la Tardoire
79 : vallée de l’Argenton (nombreux sites), vallée de la cascade de Pommiers
86 : Iles de Pont (Ligugé), vallée de la Gartempe (Lathus-Saint-Rémy, Saulgé)
Les parois siliceuses abritent 2 fougères rares en région Poitou-Charentes