Riche en eaux courantes, la région compte aussi une grande variété d’eaux stagnantes continentales ou littorales. Plusieurs zones de marais constituent des sites tout à fait exceptionnels à l’échelle européenne. A l’exception du Marais poitevin en partie sur le territoire des Deux-Sèvres et de la Vendée, ces marais se trouvent tous en Charente-Maritime, seul département de la région à bénéficier d’un littoral. Ils totalisent une superficie d’environ 85 000 ha. Les eaux y sont douces ou saumâtres. Plusieurs de ces zones humides sont d’anciens marais salants aujourd’hui reconvertis pour la plupart en espaces à vocation conchylicole, notamment en claires ostréicoles. C’est le cas des marais de la Seudre, de ceux de l’Ile de Ré et de quelques-uns sur Oléron. Les marais les plus intéressants pour les libellules sont cependant les marais arrière-littoraux possédant un réseau complexe de fossés et de canaux, et parfois riches de dépressions inondables (les jas) non connectées à ce réseau. Le Marais poitevin qui occupe une superficie de 20 000 ha en Poitou-Charentes, les marais de Brouage et ceux de Rochefort, le delta de la Seugne, sont les plus importantes de ces zones humides particulièrement propices au développement des libellules. Les marais continentaux sont plus rares et de superficie bien plus réduite. Ils sont tous de plus en plus drainés et fortement dégradés par l’agriculture intensive. On peut citer le marais de Gensac-la-Pallue, le delta de la Seugne, les tourbières alcalines de Vendoire dans la vallée de la Nizonne et celles des Régeasses dans le Montmorillonnais.

De nombreux plans d’eau parsèment la région. Les plus vastes sont les quatre lacs de barrage : Touche-Poupard et Cébron-Puy Terrier en Deux-Sèvres et Mas-Chaban et Lavaud en Charente. Toutefois, la plupart de ces plans d’eau sont des étangs de taille moyenne ou petite, artificiels et très aménagés. Leur densité est inégale sur le territoire : le Confolentais, le Montmorillonais et la Gâtine sont les zones qui en comptent le plus. Beaucoup servent pour les loisirs, notamment pour la pêche et la chasse, ou sont des réserves d’eau pour l’irrigation. Certains sont aussi nés de l’extraction de sable ou d’argile. Dans certains cas, propres et bien végétalisés, ils peuvent présenter un réel intérêt pour les odonates. Par exemple, les étangs de Combourg et de Pleuville, à l’est, accueillent une odonatofaune particulièrement riche.
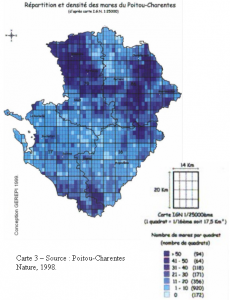
Enfin, on estime à 30 000 le nombre de mares dans la région. Leur répartition dépend beaucoup des sols et des paysages. Les zones bocagères traditionnellement vouées à l’élevage, avec des sous-sols plutôt imperméables, sont particulièrement riches en mares. C’est le cas des environs de Bressuire et de Parthenay en Deux-Sèvres et du Sud-est de la Vienne. On trouve aussi beaucoup de ces pièces d’eau sur des sols argilo-sableux, sur les terres de brandes de la Vienne mais aussi en Haute-Saintonge à l’extrême sud de la région. Les mares à la biodiversité la plus riche et donc les plus intéressantes pour les odonates sont très souvent celles en réseau.
Les 3 000 mares permanentes de la réserve du Pinail en Vienne sont ainsi particulièrement remarquables. Les mares, à l’instar d’autres zones humides, sont très menacées et leur nombre diminue rapidement sur tout le territoire.
Pour finir, il faut noter la multiplication actuelle, liée à l’évolution législative récente, de nouveaux milieux humides stagnants d’origine directement anthropique : les bassins de stockage des effluents routiers et les stations de lagunage pour l’épuration des eaux usées. La qualité de l’eau dans ces milieux est par définition médiocre mais il est intéressant d’en voir certains bien colonisés par plusieurs espèces de libellules, en particulier les plus pionnières.