Introduction
Pour mieux comprendre le monde du vivant, les scientifiques classent les organismes vivants dans un système de groupes hiérarchisés divisé en règnes, embranchements, classes et ordres notamment. L’ordre des odonates (Odonata) qui rassemble l’intégralité des espèces de libellules au sens large, fait partie du règne animal (Animalia), de l’embranchement des arthropodes (Arthropoda) et de la classe des insectes (Hexapoda).
Odonates ou libellules ?
Les insectes de l’ordre des odonates sont communément appelés libellules en français. On trouve parfois une acception différente à ce dernier terme, correspondant à la distinction entre zygoptères et anisoptères. On parle alors de demoiselles pour les premières et de libellules pour les secondes.
Le terme odonates est formé par l’agrégation des termes grecs odo dent et nate, déformation de gnath mâchoire. Les odonates sont des insectes aux mandibules très puissantes, comme des dents. Attention, le terme odo-nate est masculin !
Les odonates se divisent en trois sous-catégories. Les zygoptères – ou demoiselles – sont généralement de petite taille et ont les ailes antérieures et postérieures de forme identique. Les yeux sont largement séparés. Les anisozygoptères (renommés Epiophlébioptères) n’existent pas en Europe. Il s’agit d’un sous-ordre fossile uniquement représenté aujourd’hui par deux espèces asiatiques du genre Epiophlebia. Les anisoptères – ou libellules – sont généralement de plus grande taille. Les ailes postérieures sont plus larges à la base que les antérieures. Au repos, elles sont maintenues écartées du corps, plus ou moins à l’horizontale. Les yeux sont contigus ou relativement proches. Ces deux derniers groupes sont parfois rassemblés depuis peu au sein du sous-ordre des Epiproctophores.

Une longue histoire
C’est au Carbonifère, il y a 335 millions d’années, qu’apparaissent les premiers ancêtres des libellules, les Odonatoptères. Leurs fossiles attestent du gigantisme de certaines espèces, dont l’envergure pouvait atteindre 70 cm !
Les premiers fossiles de véritables odonates ont été trouvés dans des couches du Permien moyen, il y a 260 millions d’années. Il s’agissait de zygoptères très proches de nos espèces actuelles. A partir du Trias apparaissent les premiers anisoptères, mais les plus anciens fossiles d’aeschnes et les gomphidés ne datent que du Jurassique ancien (Silsby, 2001).
Les libellules résistent à l’extinction massive de la fin du Crétacé, qui marque la disparition des dinosaures. Elles poursuivent leur évolution et se maintiennent jusqu’à nos jours sous la forme d’insectes ayant finalement très peu évolué morphologiquement depuis les premiers âges.
Les libellules dans le monde
Existant avant la dérive des continents, capables d’effectuer de grands déplacements pour coloniser de nouveaux milieux, les libellules sont présentes dans la quasi-totalité des terres émergées non gelées de la planète.
Environ 6 000 espèces de libellules ont été décrites à ce jour (Schorr et al., 2009). La répartition de ces espèces n’est pas homogène à l’échelle planétaire. La plus grande diversité spécifique se trouve dans les régions tropicales n’ayant jamais subi l’influence des glaciations. En Europe, une succession de périodes glaciales impliquant une série de processus de disparitions et de recolonisations a fortement limité la diversité spécifique. A chaque période froide, les odonates ont dû refluer dans le sud du continent, se retrouvant coincés dans de petits espaces relictuels des péninsules ibérique, italienne et balkanique, où les espèces les plus sensibles n’ont pas pu se maintenir.
En Amérique du Nord, les libellules ont pu échapper au froid en régressant vers le sud. La faune nord-américaine, composée de 433 espèces, est donc beaucoup plus riche que la faune européenne (135 espèces). A titre d’exemple, le Québec, avec 138 espèces, abrite deux fois plus d’espèces que l’ouest de la France (Pilon & Lagacé, 1998).
Certaines régions isolées abritent des odonatofaunes parfois très riches. L’Australie héberge à elle seule 324 espèces dont beaucoup d’endémiques, c’est-à-dire qu’on ne trouve que là au monde (Theischinger & Hawking, 2006). L’inventaire préliminaire de Madagascar a déjà révélé la présence d’au moins 175 espèces, dont près de 75 % d’endémiques (Dijkstra, 2007).
Les régions les plus riches sont malheureusement les moins bien connues. Afrique tropicale, Amazonie, Asie du Sud-Est ne font l’objet que d’inventaires récents et des dizaines de nouvelles espèces y sont découvertes annuellement. L’inventaire de l’Inde a déjà révélé la présence de plus de 500 espèces (Subramanian, 2005), celui du Venezuela 453 espèces (De Marmels, 1990), le seul Bélize, plus petit que le Poitou-Charentes, héberge près de 230 espèces (Boomsma & Dunkle, 1996).

Le monde des libellules
Pour coloniser des milieux aussi différents que les terres glaciales de l’Arctique, les déserts d’Asie centrale et les forêts tropicales, les odonates ont adopté des stratégies d’adaptation souvent remarquables.
Des écologies étonnantes
Les larves de libellules se développent dans des milieux aquatiques. Rivières, lacs et mares sont des habitats classiques mais certaines espèces ont colonisé des sites de développement larvaire beaucoup plus originaux.
Dans les régions tropicales humides, plusieurs espèces pondent leurs œufs dans les petites réserves d’eau accumulées entre les feuilles des broméliacées. En Asie, les bambous creux sont aussi utilisés comme site de reproduction. Certaines espèces d’Afrique tropicale se développent même dans la litière humide des forêts, à l’écart de tout point d’eau.
En Nouvelle Zélande, les Uropelata pondent dans le sol des clairières forestières détrempées. Les larves vont y mener leur complet développement, enfouies dans un terrier creusé dans la tourbe.
Certaines libellules sont même capables de survivre dans les déserts. Grandes voyageuses, elles suivent les dépressions et pondent dans les flaques d’eau temporaires accumulées dans les rochers, après des orages. Leurs larves s’y développent en un temps record pour éviter la dessiccation.

Du plus grand au plus petit
Le plus grand odonate actuellement connu est Megaloprepus coerulatus, long de 12 cm et dont l’envergure atteint 19 cm. Son abdomen effilé lui permet de pondre ses œufs dans des trous d’arbres inondés des forêts brumeuses d’Amérique centrale.
Le plus petit odonate connu vit en Asie orientale et se nomme Nannophya pygmaea. Il ne mesure que 15 mm de long pour une envergure de 20 mm, soit la taille d’une grosse mouche.
Des insectes diversement colorés
La coloration des odonates est remarquable et varie fortement selon les espèces. Certaines libellules jouent la carte de la discrétion en se fondant dans leur environnement par une coloration camouflée. D’autres, au contraire, présentent des colorations très vives, arborant des taches alaires métalliques, des colorations ou des marques corporelles bleues, rouges, orange, souvent utilisées par les mâles pour attirer les femelles.
La typologie d’une libellule
Ici un Orthétrum brun Orthetrum brunneum.
Les odonates sont pourvus de trois paires de pattes et de quatre ailes indépendantes. Leur corps se divise en trois parties principales : la tête, le thorax et l’abdomen.

Philippe JOURDE & Miguel GAILLEDRAT
Bibliographie
Boomsma T., Dunkle S.W., 1996 – Odonata of Belize. Odonatologica, 25 (1) : 17-29.
De Marmels J., 1990 – An updated checklist of the Odonata of Venezuela. Odonatologica, 19 : 333-345.
Dijkstra K.-D. B., 2007 – Demise and rise : the biogeography and taxonomy of the Odonata of tropical Africa. PhD Thesis, Leiden University, pp. 143-187.
Pilon P.G., Lagacé D., 1998 – Les odonates du Québec. Traité faunisti-que. Entomofaune du Québec Inc., Chicoutimi, Québec, 367 p.
Silsby J., 2001 – Dragonflies of the world. The Natural History Museum & CSRIRO publishing, 216 p.
Schorr M., Lindeboom M., Paulson D., 2009 – World odonata list. Slater Museum of Natural History, University of Puget Sound, téléchargement du 05/08/2009 : http://nhmuseum.ups.edu/World Odonata.xls.
Subramanian K.A., 2005 – Dragonflies and damselflies of Peninsular India. A field guide. Project Lifescape. Centre for Ecological Sciences, Indian Institute of Science, Indian Academy of Sciences, Bangalore, 118 p.
Theischinger G., Hawking J., 2006 – The complete field guide to dragonflies of Australia. CSIRO publishing, Collingwood, 366 p.

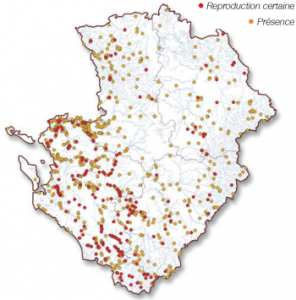
 Cette espèce est commune en Poitou-Charentes. Elle n’y est pas réellement menacée. Cependant, conséquence de l’intensification de l’agriculture, la disparition des mares, année après année, est préoccupante pour cette espèce comme pour beaucoup d’autres odonates. De plus, ce leste peut souffrir d’une élimination non réfléchie et intempestive de la végétation des berges des cours d’eau et des plans d’eau.
Cette espèce est commune en Poitou-Charentes. Elle n’y est pas réellement menacée. Cependant, conséquence de l’intensification de l’agriculture, la disparition des mares, année après année, est préoccupante pour cette espèce comme pour beaucoup d’autres odonates. De plus, ce leste peut souffrir d’une élimination non réfléchie et intempestive de la végétation des berges des cours d’eau et des plans d’eau.

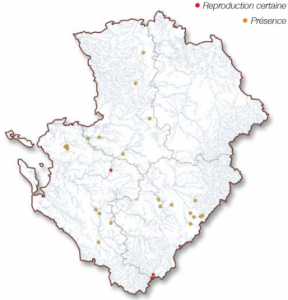
 disposant d’un ensoleillement suffisant. L’assèchement estival des cours d’eau, lié à un déficit de la ressource en eau du fait notamment de la présence de nombreux pompages, de barrages et de seuils sur les cours d’eau, affecte gravement les populations de caloptéryx.
disposant d’un ensoleillement suffisant. L’assèchement estival des cours d’eau, lié à un déficit de la ressource en eau du fait notamment de la présence de nombreux pompages, de barrages et de seuils sur les cours d’eau, affecte gravement les populations de caloptéryx.
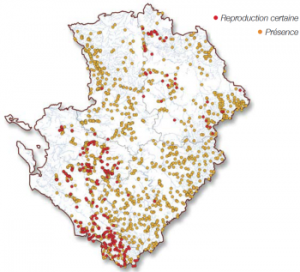










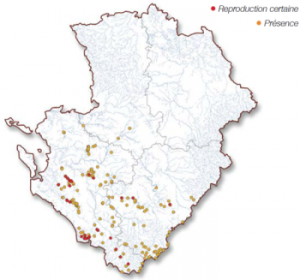
 Ce leste ne semble pas menacé en Poitou-Charentes. Cependant, la disparition ou la dégradation des mares et des petites pièces d’eau ne peut que nuire à l’espèce. De plus, la transformation ou la création de nombreux étangs pour des activités piscicoles et présentant des rives aux faciès abrupts n’offrent pas de milieux de substitution pour le développement des larves de S. fusca qui ont besoin d’un niveau d’eau inférieur à cinquante centimètres afin que le réchauffement soit rapide.
Ce leste ne semble pas menacé en Poitou-Charentes. Cependant, la disparition ou la dégradation des mares et des petites pièces d’eau ne peut que nuire à l’espèce. De plus, la transformation ou la création de nombreux étangs pour des activités piscicoles et présentant des rives aux faciès abrupts n’offrent pas de milieux de substitution pour le développement des larves de S. fusca qui ont besoin d’un niveau d’eau inférieur à cinquante centimètres afin que le réchauffement soit rapide. Trois menaces principales affectent cet odonate. L’assèchement chronique des cours d’eau, lié à une mauvaise gestion de la ressource, notamment du fait de pompages agricoles déraisonnables, affecte de nombreuses populations.
Trois menaces principales affectent cet odonate. L’assèchement chronique des cours d’eau, lié à une mauvaise gestion de la ressource, notamment du fait de pompages agricoles déraisonnables, affecte de nombreuses populations.



