Rédacteur : Olivier Collober
Physionomie ècologie
L’habitat se rattache sur le plan structurel aux habitats qui constituent la strate supérieure de la végétation des eaux calmes. Il s’agit de communautés d’hydrophytes non fixées, généralement flottantes, parfois immergées, constituant des tapis plus ou moins denses et recouvrant, qui colonisent les eaux stagnantes des mares et des petits étangs, ou à très faible courant des bras morts de rivière, des canaux et des fossés de drainage des marais.
A la différence de l’habitat « Eau avec végétation flottante fixée » (22.43), ces formations végétales ne sont pas enracinées et disposent d’une relative autonomie, qui leur permet d’évoluer librement (pleustophytes) en surface, entre deux eaux ou à proximité du fond. Cette particularité, fondée sur des similitudes morphologiques et écologiques entre les espèces indicatrices, témoigne également d’une adaptation au milieu aquatique sur le plan biologique, plus particulièrement, de la capacité à assimiler les ressources disponibles dans l’eau, soit directement en puisant les éléments nutritifs dissous, soit indirectement en piégeant des organismes vivants (utriculaires).
L’habitat associe des espèces de tailles et de complexité variables (phanérogames, cryptogames, hépatiques) comme de grandes espèces (Hydrocharis, Stratiotes) pourvues d’un appareil végétatif et floral complet, parfois très spécialisé (utriculaires), par opposition aux espèces de taille plus modeste et de complexité moindre (lemnacées, Riccia, Azolla). Deux ensembles peuvent ainsi être identifiés : les formations souvent monospécifiques dominées par de grandes pleustophytes submergées et les formations plus diversifiées de petites ou moyennes pleustophytes flottantes à la surface ou à proximité.
Il s’agit toujours d’espèces annuelles (hydrothérophytes) souvent très prolifiques, qui peuvent constituer de grandes populations et qui disposent d’un fort pouvoir colonisateur par multiplication végétative et d’une capacité de dissémination importante (transport par le courant, les oiseaux ou le bétail). Il s’agit aussi d’espèces eurythermes. Nettement thermophiles pendant la phase de développement, elles affectionnent la pleine lumière ou la mi-ombre et les eaux peu profondes (inférieures à 1,5 mètre) qui se réchauffent rapidement et accélèrent la reproduction végétative.
Ces espèces non fixées, sont facilement entraînées à la surface et sont ainsi limitées par le courant et par le vent. Inversement, les eaux stagnantes des petits plans d’eau ou les courants très lents des canaux et des fossés, en situation ouverte et abritée, conviennent particulièrement aux pleustophytes qui peuvent alors se montrer envahissantes et recouvrir une grande partie ou la totalité de la surface de l’eau.
Par ailleurs, les adaptations biologiques propres à ces espèces pour exploiter les ressources disponibles dans l’eau, les rendent très dépendantes du gradient trophique. De ce fait, l’habitat se rencontre principalement dans les eaux riches en éléments nutritifs dissous (mésotrophes à eutrophes, parfois hypertrophes) et plus rarement dans les eaux oligotrophes (plantes carnivores uniquement). Dans sa configuration type, l’habitat se rencontre en conditions eutrophes et regroupe fréquemment plusieurs espèces indicatrices (Lemnacées, Azolla filiculoides, Hydrocharis morsus-ranae), vivant en association et/ou développant des populations successives en raison d’une évolution du niveau trophique, plus rarement par une espèce monospécifique (Utricularia vulgaris). Spirodela polyrhiza tolère des situations en partie ombragées et des eaux moins chaudes alors qu’Azolla ou Wolffia colonisent surtout les eaux à fort réchauffement estival. Plusieurs de ces espèces sont également relativement halophiles et prospèrent dans les eaux subsaumâtres des marais arrière-littoraux ou des mares dunaires.
En Poitou-Charentes, la configuration type associant les formations de lentilles et d’Hydrocharis est présente un peu partout, tout particulièrement dans les grands marais planitiaires (Marais Poitevin et marais charentais) et ce, jusqu’à proximité du littoral. La « Venise Verte » tire ainsi directement son nom de la physionomie de ces tapis de lentilles d’eau visibles à la surface des conches et des canaux. En contexte acide, l’habitat devient moins courant et occupe de préférence les mares et les petits étangs eutrophes, les fosses oligotrophes des carrières d’extraction d’argile (Utricularia australis) et les zones de sources (Riccia fluitans).
Phytosociologie et correspondances typologiques
COR 1997
22. 41 Végétations flottant librement : communautés flottant librement à la surface des eaux plus ou moins riches en nutriments
22.411 Couvertures de Lemnacées, Azolla ou hépatiques
22.412 Radeaux d’Hydrocharis morsus-ranae
22.413 Radeaux de Stratiotes aloides
22.414 Colonies d’utriculaires
PVF 2004
LEMNION MINORIS O.Bolos & Masclans 1955 : communautés des eaux eutrophes à hypertrophes
LEMNION TRISULCAE Hartog et Segal 1964 : communautés des eaux oligo-mésotrophes à méso-eutrophes.
Directive Habitats 1992 et Cahiers d’habitats
3150-3 « Plans d’eau eutrophes avec dominance de macrophytes libres flottants à la surface de l’eau »
3150-4 « Rivières, canaux et fossés eutrophes des marais naturels »
Confusions possibles
Dans sa configuration type, l’habitat ne peut être confondu avec aucun autre habitat des eaux calmes.
Dynamique
Les tapis de pleustophytes constituent des formations pionnières dans la dynamique de la végétation aquatique des eaux calmes.
Le maintien de ces espèces annuelles dépendra du renouvellement et de la conjonction de facteurs écologiques favorables, ce qui confère à l’habitat un caractère instable et précaire.
Parmi ces facteurs, la minéralisation des eaux favorise le développement de tapis flottants qui deviennent largement dominants (Lemnacées, Hydrocharis) et limitent celui des autres formations. De plus, contrairement aux espèces des autres habitats des eaux calmes, pour lesquelles la profondeur de l’eau est un facteur limitant qui entraîne une zonation précise des formations, celles qui relèvent de l’habitat « Eau avec végétation flottante libre » peuvent évoluer librement et, de ce fait, occuper toute la surface de l’eau dès lors que les conditions de leur développement sont réunies. A ce stade plus avancé, la prolifération de certaines espèces (Lemna gibba, Lemna minor, Spirodela polyrhiza, Azolla filiculoides, Riccia sp.) favorisée par une forte multiplication végétative, aboutit à la formation de plusieurs couches superposées et devient un facteur de régression pour les autres habitats des eaux calmes, interdisant, par exemple, la captation des rayons lumineux par les hydrophytes immergés. Parallèlement, cette prolifération accélère la décomposition de la matière végétale sur le fond dans des conditions anaérobies, augmente les échanges gazeux avec le milieu aquatique, provoque un abaissement du taux d’oxygène et libère de l’ammoniac, ce qui peut, en période de fortes chaleurs, avoir des conséquences dévastatrices pour l’ensemble des espèces, animales et végétales. En cela, les communautés de Lemnacées permettent d’apprécier la qualité physico-chimique des eaux et ont ainsi une valeur bio indicatrice.
En profondeur moyenne, ces formations sont néanmoins concurrencées par des hydrophytes flottants enracinés, comme le Nénuphar jaune. De plus, ces espèces stagnophiles supportent mal l’action du courant et du vent ou une arrivée d’eau massive qui entraînent une fragmentation des tapis et une destruction du faciès caractéristique.
Notons enfin, que l’explosion spectaculaire de ces tapis de pleustophytes flottants, qui trouvent dans la dégradation de la qualité des eaux les conditions optimales de leur développement, n’est que le témoin visuel d’une eutrophisation rapide qui accélère encore d’avantage le processus d’évolution naturelle conduisant progressivement au comblement du milieu.
Espèces indicatrices
| [plante2] | (Azolla filiculoides), Hydrocharis morsus-ranae, Lemna gibba, Lemna minor, (Lemna minuta), Lemna trisulca, Spirodela polyrhiza, *Stratiotes aloides, Wolffia arrhiza |
| [plante1] | (Ludwigia grandiflora), (Ludwigia peploides), Myriophyllum aquaticum, Phragmites australis, Typha angustifolia, Typha latifolia, *Utricularia australis, *Utricularia vulgaris |
| [briophytes] | Riccia fluitans, Ricciocarpus natans |
| [amphibiens] | Rana perezi |
| [mollusques] | Anisus spirorbis, Oxyloma elegans, Stagnicola fuscus |
| [odonates] | Erythromma viridulum |
Valeur biologique
Si les formes eutrophes et, surtout, hypertrophes, de l’habitat sont assez répandues et tendent même à se développer avec la dégradation généralisée des milieux aquatiques, les faciès mésotrophes ou méso-eutrophes sont beaucoup plus rares. C’est dans ce faciès d’eaux mésotrophes drainant un marais tourbeux de Charente-Maritime que se localise l’unique station picto-charentaise de l’Aloès d’eau Stratiotes aloides, une Hydrocharitacée plutôt médio-européenne, très rare dans l’Ouest de la France, dont les rosettes foliaires immergées viennent flotter à la surface de l’eau au moment de la floraison. C’est également dans de faciès de l’habitat que se développe le Petit Nénuphar Hydrocharis morsus-ranae, une espèce en régression spectaculaire au cours des 2 dernières décennies dans tous les marais arrière-littoraux charentais. Bien que l’habitat ait beaucoup à souffrir des pullulations d’espèces invasives – au premier rang desquelles les jussies néo-tropicales – celles-ci peuvent toutefois avoir un impact indirect « bénéfique » : avec la séquestration massive de nutriments provoquée par la croissance de l’énorme biomasse des jussies, les eaux, initialement eutrophes, deviennent moins chargées et peuvent alors être colonisées par des utriculaires (Utricularia vulgaris et Utricularia australis), des espèces rares et liées généralement à la périphérie de marais tourbeux.
En revanche, lorsque l’habitat témoigne d’une eutrophisation d’origine anthropique, processus très rapide d’augmentation en substances nutritives qui génère une explosion de certaines espèces indicatrices au détriment de la diversité des autres espèces, ou lorsque celui-ci est composé, de manière monospécifique, par une espèce courante, ou par des espèces invasives (Azolla filiculoides, Lemna minuta), il présente alors une valeur patrimoniale faible et bien moindre que celle des formations qu’il tend à remplacer. En effet, dans un contexte d’eutrophisation importante, seules quelques espèces faunistiques ou floristiques arrivent à se maintenir et à exploiter les tapis de pleustophytes dont l’intérêt principal réside en l’apport nutritif qu’ils représentent pour les plus résistantes (poissons) ou pour certains oiseaux. Compte tenu de l’eutrophisation généralisée des eaux, d’origine agricole, la configuration type de l’habitat élémentaire est en nette régression partout. Dans ces conditions, la préservation des systèmes mésotrophes ou naturellement eutrophes devrait être prioritaire par rapport aux systèmes dégradés (eutrophisation ou hypertrophisation d’origine anthropique) en attendant que des mesures globales sur les causes de cette dégradation soient entreprises pour rétablir les conditions favorables à des formations plus complexes et plus intéressantes du point de vue de la biodiversité.
Menaces
Indépendamment des conséquences provenant de l’eutrophisation (diminution de la diversité, comblement…), ces formations sont sensibles à une acidification des eaux, à une modification des conditions hydriques, au développement d’espèces allochtones compétitives (jussies ou pleustophytes invasives), à un assèchement prolongé, et, s’agissant des espèces les plus héliophiles, à la fermeture du milieu.
Dans certains secteurs du Poitou-Charentes enfin (marais arrière-littoraux), la prolifération d’espèces animales allochtones (ragondin, rat musqué et, récemment, écrevisses américaines) a un tel impact sur les milieux aquatiques (turbidité des eaux, consommation des herbiers aquatiques) que même les nappes de lentilles d’eau ont du mal à survivre dans ces milieux très dégradés.
Statut régional
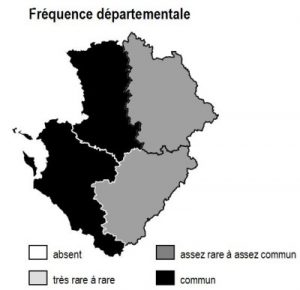
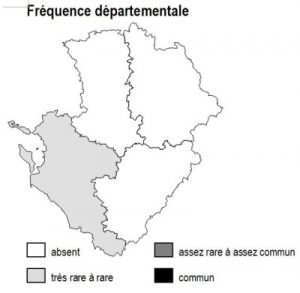
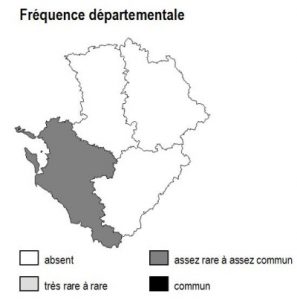
L’habitat est globalement répandu en Poitou-Charentes, avec toutefois une fréquence particulièrement élevée dans les grands marais arrière-littoraux de Charente-Maritime (fossés des marais de Rochefort, Brouage, estuaire Gironde) et le sud-ouest des Deux-Sèvres (Marais Poitevin : « Venise verte »).